
取消
清空記錄
歷史記錄
清空記錄
歷史記錄



【文獻分享】腦靶向脂質納米顆粒:緩解缺血性中風后的神經炎癥

缺血性腦卒中作為全球范圍內成人第二大致死病因,在我國更是成人致殘和死亡的首要原因,約占所有腦卒中病例的 80%,具有高發病率、高復發率、高致殘率及高經濟負擔的顯著特點。目前,靜脈溶栓與機械取栓雖為急性缺血性腦卒中治療的金標準,但受限于狹窄的治療時間窗及再灌注損傷風險,臨床應用效果受限,因此開發能有效抑制缺血性腦卒中后神經炎癥、減輕腦損傷的新型療法迫在眉睫。
缺血性腦卒中后,小膠質細胞中 NADPH 氧化酶(NOX)介導的氧化應激是神經炎癥和細胞死亡的關鍵驅動機制。而電壓門控質子通道 Hv1 在小膠質細胞中高表達,與 NOX 協同產生活性氧(ROS),加劇腦損傷。此前研究發現,新型 Hv1 抑制劑 YHV984 具有高特異性,但存在兩大缺陷:水溶性差,限制體內遞送;全身給藥易引發脫靶效應(Hv1 在巨噬細胞、脾細胞等外周組織也有分布),導致毒副作用。因此,研究需為其設計 “靶向遞送載體”,實現腦內小膠質細胞的精準富集。
脂質納米顆粒(LNP)是目前生物醫藥領域的明星載體,它不僅能根據需求進行各種修飾,還和人體的相容性很好,早已在膠質瘤、阿爾茨海默病等腦部疾病的治療中廣泛應用。T7肽是一種能精準對接腦血管內皮細胞上轉鐵蛋白受體的物質,增強藥物穿越血腦屏障(BBB)的能力。近日,珠江醫院段傳志教授團隊在Journal of Nanobiotechnology發表研究“Brain targeted lipid nanoparticles with Hv1 inhibitors alleviate neuroinflammation post-ischemic stroke”,構建了一種搭載 Hv1 抑制劑 YHV984 的腦靶向脂質納米顆粒 T7-LNP@YHV984,為缺血性腦卒中后神經炎癥的治療提供了新思路。
T7-LNP@YHV984則采用薄膜水化-透析法制備,將YHV984 加入含 DLin-MC3-DMA、DSPC、膽固醇、DSPE-PEG2000-T7(摩爾比 50:10:38.5:1.5)的脂質乙醇溶液,混合后滴入檸檬酸鈉緩沖液,經透析獲得。同時制備了不含 YHV984的T7-LNP、非靶向LNP(eLNP)納米顆粒作為對照。對制備的納米顆粒進行表征發現,T7-LNP@YHV984 平均粒徑為 108 nm,Zeta 電位為- 18.5 mV,呈規則球形,4℃下儲存 30天粒徑無著變化,YHV984包封率達 92.7%,體外釋放呈現 “先快后慢” 特征,48 h釋放率超 80%,藥代動力學研究顯示其體內半衰期為 11.97 小時,顯著長于游離 YHV984(1.75 小時),藥時曲線下面積(AUC)為 71.15 μg/mL?h,清除率(CL)為 0.34 mL/h,表明其具有良好的穩定性、可控的藥物釋放能力及優異的藥代動力學性能。
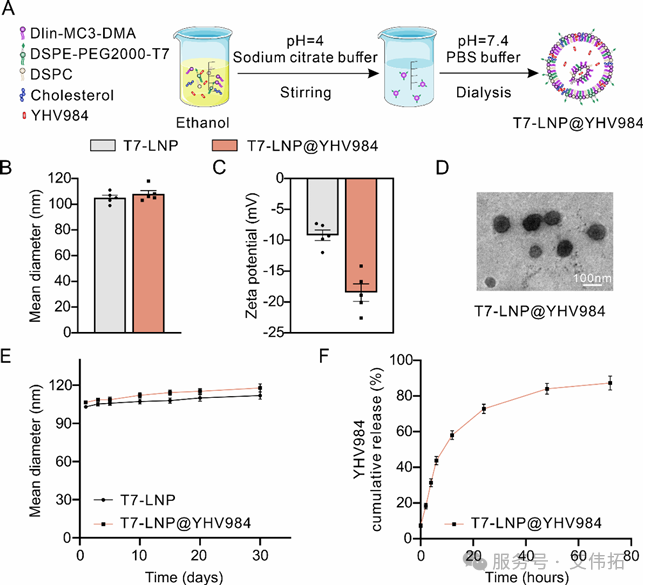
Fig. 1 T7-LNP@YHV984的制備與表征
體外細胞實驗進一步驗證了 T7-LNP@YHV984 的生物相容性、靶向能力及抗炎效果。血腦屏障穿透實驗中,基于 bEnd.3 細胞的模型顯示,T7-LNP@YHV984 的跨膜熒光強度顯著高于非靶向 eLNP,證明T7肽可有效介導其跨越血腦屏障;小膠質細胞靶向與調控實驗發現,BV2 細胞對T7-LNP@YHV984 的攝取率遠高于 T7-LNP和 eLNP,且能顯著抑制 LPS 誘導的BV2細胞向M1表型極化,促進其向 M2 表型極化,同時降低OGD處理BV2細胞的ROS水平,降低原代神經元凋亡率,并顯著提高HUVEC細胞的劃痕愈合率,體現出對神經元的保護及血管修復作用。
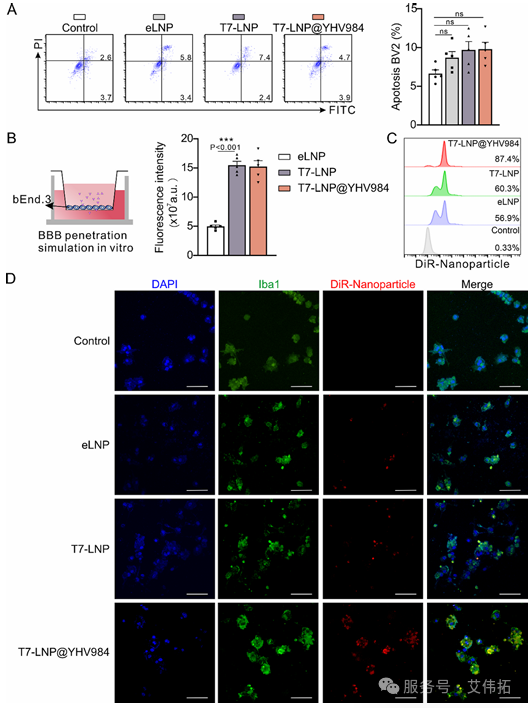
Fig. 2 細胞水平T7-LNP@YHV984的生物相容性和靶向能力
體內動物實驗則全面證實了T7-LNP@YHV984的腦靶向性、安全性及治療效果。腦靶向性驗證中,tMCAO模型小鼠尾靜脈注射DiR標記的 T7-LNP@YHV984 后,8小時腦內熒光強度達峰值,且顯著高于T7-LNP,免疫熒光染色顯示納米顆粒與小膠質細胞共定位,證明其具有優異的腦內富集能力和小膠質細胞靶向特異性。
Fig. 3 tMCAO小鼠中T7-LNP@YHV984體內靶向能力
治療效果方面,T7-LNP@YHV984可顯著增加梗死區腦血流恢復、降低腦梗死體積,改善神經功能。分子機制研究發現,T7-LNP@YHV984 能顯著下調腦內 Hv1、NOX2、NLRP3 蛋白表達,減少促炎因子浸潤,增加抗炎因子水平,降低 TUNEL 陽性神經元比例,從分子層面證實了其抗炎及神經保護作用。
Fig.4 T7-LNP@YHV984表現出優異的抗炎和促進神經修復能力
總的來說,T7-LNP@YHV984 的研發為缺血性腦卒中治療開辟了精準靶向抗炎的新路徑。它的優勢很突出:載體核心成分 DLin-MC3-DMA 早已在臨床應用中得到驗證,安全性有保障;T7 肽與轉鐵蛋白受體結合的靶向機制清晰,能讓藥物直擊病灶;還能同時解決現有治療手段面臨的時間窗窄、易引發再灌注損傷、副作用大等難題。未來若能突破肝臟攝取和長期毒性等瓶頸,有望成為缺血性腦卒中急性期與恢復期聯合治療的候選方案,推動神經保護療法從廣譜抗炎向精準調控邁進。
文中涉及產品清單:
自2007年成立以來,艾偉拓始終致力于服務中國制劑產業,為高端制劑提供特種輔料和高品質服務。已建成100+品種藥用輔料產品庫,其中50+已完成CDE登記,18個品種已通過關聯審評應用于已上市注射制劑中。
經過近20年潛心深耕,艾偉拓已實現脂質體/核酸遞送領域的全輔料供應,有力支持國內復雜制劑的研發生產與中外申報,歡迎來詢!
艾偉拓產品團隊將持續為您分享艾基金高分文獻解讀,盡請期待!
感謝珠江醫院段傳志教授團隊楊澤宇老師供稿!
原文鏈接:
https://pubmed.ncbi.nlm.nih.gov/40598588/
艾基金重要消息
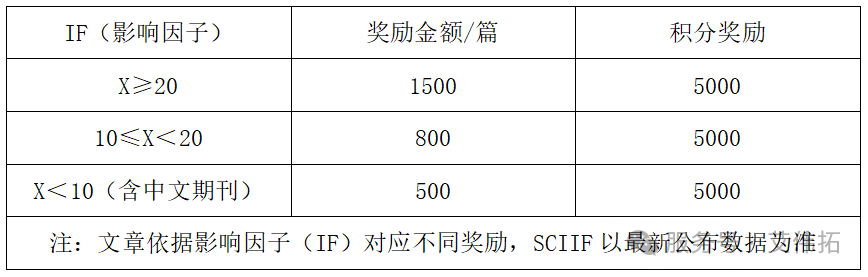
2025年11月1日起,艾基金規則迎來優化:獎勵機制升級為梯度發放,并新增線下沙龍、展會贊助等專屬活動。具體活動規則請查看:“艾基金”活動升級公告 。 發文章領“艾基金” 為答謝客戶 助力新制劑開發 艾偉拓成立“艾基金” 對使用AVT產品并發表論文的個人進行獎勵 “艾基金” 活動規則 1、參與條件 實驗過程中需使用艾偉拓指定高端輔料產品(可申領產品范圍詳見下圖)。 2、論文要求 ? 已發表文章中必須注明公司正式全稱,可選用以下任一形式: 中文:“艾偉拓 (上海) 醫藥科技有限公司” 英文:“AVT (SHANGHAI) PHARMACEUTICAL TECH CO., LTD” ? 申請時需上傳完整的已發表論文PDF文件(如有補充材料 SI,須一并上傳)。 3、領獎資格 領獎人須為論文第一作者、第二作者或通訊作者;每篇文章僅限參與一次,不可重復申請。 4、審核與發放 成功提交申請后,我司將于次月統一審核,審核通過后在下月安排獎勵發放,整個過程約需3個月。 5、獎金說明 獎勵金額為稅前金額,由艾偉拓預繳勞務報酬個人所得稅后,將剩余款項打款至申請人賬戶(具體獎勵金額詳見表單)。 6、本活動最終解釋權歸艾偉拓 (上海) 醫藥科技有限公司所有。 申領方式 (1) 掃碼關注公眾號,回復“艾基金” (2) 點擊鏈接,填寫表單





 瀏覽器自帶分享功能也很好用哦~
瀏覽器自帶分享功能也很好用哦~




